નાઇટ્રેટ અને નાઇટ્રાઇટ વચ્ચેનો મુખ્ય તફાવત એ છે કે નાઇટ્રેટમાં નાઇટ્રોજન અણુ સાથે બંધાયેલા ત્રણ ઓક્સિજન અણુઓ હોય છે જ્યારે નાઇટ્રાઇટમાં નાઇટ્રોજન અણુ સાથે બંધાયેલા બે ઓક્સિજન અણુ હોય છે.
નાઇટ્રેટ અને નાઇટ્રાઇટ બંને નાઇટ્રોજન અને ઓક્સિજન અણુઓનો સમાવેશ કરાયેલ અકાર્બનિક એનિઓન્સ છે. આ બંને આયનોમાં -1 ઇલેક્ટ્રિકલ ચાર્જ છે. તેઓ મુખ્યત્વે મીઠાના સંયોજનોની આયન તરીકે થાય છે. નાઇટ્રેટ અને નાઇટ્રાઇટ વચ્ચે કેટલાક તફાવત છે; અમે આ લેખમાં તે તફાવતોની ચર્ચા કરીશું.
નાઇટ્રેટ એટલે શું?
નાઈટ્રેટ એ રાસાયણિક સૂત્ર NO3– ધરાવતી અકાર્બનિક આયન છે. તે એક પોલિએટોમિક આયન છે જેમાં 4 અણુઓ છે; એક નાઇટ્રોજન અણુ અને ત્રણ ઓક્સિજન અણુ. એનિઅન પાસે -1 એકંદર ચાર્જ છે. આ આયનનો દા ola માસ 62 ગ્રામ/મોલ છે. ઉપરાંત, આ આયન તેના જોડાણ એસિડમાંથી લેવામાં આવી છે; નાઇટ્રિક એસિડ અથવા એચ.એન.ઓ. બીજા શબ્દોમાં કહીએ તો, નાઇટ્રેટ એ નાઇટ્રિક એસિડનો સંયુક્ત આધાર છે.
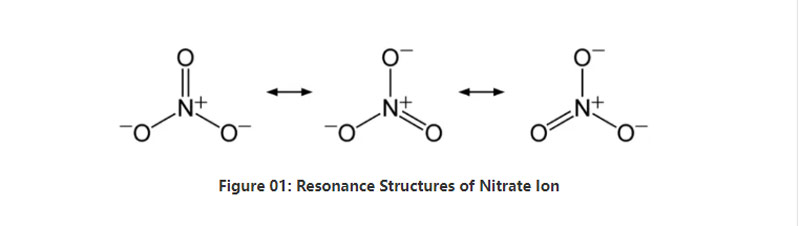
ટૂંકમાં, નાઇટ્રેટ આયનમાં કેન્દ્રમાં એક નાઇટ્રોજન અણુ છે જે સહસંયોજક રાસાયણિક બંધન દ્વારા ત્રણ ઓક્સિજન અણુઓ સાથે જોડાય છે. આ આયનની રાસાયણિક રચનાને ધ્યાનમાં લેતી વખતે, તેમાં ત્રણ સરખા કોઈ બોન્ડ્સ છે (આયનની રેઝોનન્સ સ્ટ્રક્ચર્સ અનુસાર). તેથી, પરમાણુની ભૂમિતિ ત્રિકોણાત્મક પ્લાનર છે. દરેક ઓક્સિજન અણુ -2-3 ચાર્જ વહન કરે છે, જે -1 તરીકે આયનનો એકંદર ચાર્જ આપે છે.
પ્રમાણભૂત દબાણ અને તાપમાને, આ આયન ધરાવતા લગભગ તમામ મીઠાના સંયોજનો પાણીમાં ઓગળી જાય છે. આપણે થાપણો તરીકે પૃથ્વી પર કુદરતી રીતે થતા નાઈટ્રેટ ક્ષાર શોધી શકીએ છીએ; નાઇટ્રેટીન થાપણો. તેમાં મુખ્યત્વે સોડિયમ નાઇટ્રેટ હોય છે. તદુપરાંત, નાઇટ્રાઇફાઇંગ બેક્ટેરિયા નાઈટ્રેટ આયન ઉત્પન્ન કરી શકે છે. નાઇટ્રેટ ક્ષારનો એક મોટો ઉપયોગ ખાતરોના ઉત્પાદનમાં છે. તદુપરાંત, તે વિસ્ફોટકોમાં ox ક્સિડાઇઝિંગ એજન્ટ તરીકે ઉપયોગી છે.
નાઇટ્રાઇટ એટલે શું?
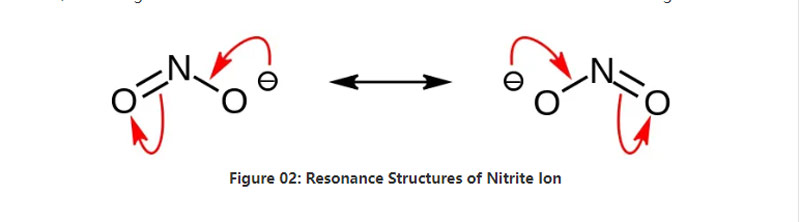
નાઇટ્રાઇટ એ રાસાયણિક સૂત્ર NO2– ધરાવતું અકાર્બનિક મીઠું છે. આ આયન એક સપ્રમાણ આયન છે, અને તેમાં એક નાઇટ્રોજન અણુ બે ઓક્સિજન અણુઓ સાથે બંધાયેલ છે જેમાં બે સરખા કોઈ સહસંયોજક રાસાયણિક બંધનો છે. તેથી, નાઇટ્રોજન અણુ પરમાણુની મધ્યમાં છે. એનિઅન પાસે -1 એકંદર ચાર્જ છે.
આયનનો દા ola માસ 46.01 ગ્રામ/મોલ છે. ઉપરાંત, આ આયન નાઇટ્રસ એસિડ અથવા એચએનઓ 2 માંથી લેવામાં આવી છે. તેથી, તે નાઇટ્રસ એસિડનો સંયુક્ત આધાર છે. તેથી, આપણે જલીય સોડિયમ હાઇડ્રોક્સાઇડ સોલ્યુશનમાં નાઇટ્રસ ધૂમાડો પસાર કરીને indust દ્યોગિક રૂપે નાઇટ્રાઇટ ક્ષારનું ઉત્પાદન કરી શકીએ છીએ. તદુપરાંત, આ સોડિયમ નાઇટ્રાઇટ ઉત્પન્ન કરે છે જેને આપણે પુન: સ્થાપના દ્વારા શુદ્ધ કરી શકીએ છીએ. તદુપરાંત, સોડિયમ નાઇટ્રાઇટ જેવા નાઇટ્રાઇટ ક્ષાર ખોરાકના સંરક્ષણમાં ઉપયોગી છે કારણ કે તે ખોરાકને માઇક્રોબાયલ વૃદ્ધિથી રોકી શકે છે.
નાઇટ્રેટ અને નાઇટ્રાઇટ વચ્ચે શું તફાવત છે?
નાઇટ્રેટ એ રાસાયણિક સૂત્ર NO3– ધરાવતી અકાર્બનિક આયન છે જ્યારે નાઇટ્રાઇટ એ રાસાયણિક સૂત્ર NO2– ધરાવતું અકાર્બનિક મીઠું છે. તેથી, નાઇટ્રેટ અને નાઇટ્રાઇટ વચ્ચેનો પ્રાથમિક તફાવત બે એનિઓન્સની રાસાયણિક રચના પર રહેલો છે. તે છે; નાઇટ્રેટ અને નાઇટ્રાઇટ વચ્ચેનો મુખ્ય તફાવત એ છે કે નાઇટ્રેટમાં નાઇટ્રોજન અણુ સાથે બંધાયેલા ત્રણ ઓક્સિજન અણુઓ હોય છે જ્યારે નાઇટ્રાઇટમાં નાઇટ્રોજન અણુ સાથે બંધાયેલા બે ઓક્સિજન અણુ હોય છે. તદુપરાંત, નાઇટ્રેટ આયન તેના જોડાણ એસિડમાંથી લેવામાં આવે છે; નાઇટ્રિક એસિડ, જ્યારે નાઇટ્રાઇટ આયન નાઇટ્રસ એસિડમાંથી લેવામાં આવે છે. નાઇટ્રેટ અને નાઇટ્રાઇટ આયનો વચ્ચેનો બીજો મહત્વપૂર્ણ તફાવત તરીકે, અમે કહી શકીએ કે નાઇટ્રેટ એક ox ક્સિડાઇઝિંગ એજન્ટ છે કારણ કે તે એકમાત્ર ઘટાડો કરી શકે છે જ્યારે નાઇટ્રાઇટ બંને ઓક્સિડાઇઝિંગ અને ઘટાડતા એજન્ટ તરીકે કાર્ય કરી શકે છે.
પોસ્ટ સમય: મે -16-2022





